台新藥研發專案
APP13007|眼科手術術後發炎及疼痛治療
臨床結果顯示,APP13007(丙酸氯倍他索奈米點眼懸液劑)為提供眼科醫師及眼科手術患者一能快速起效且持續的術後抗發炎及緩解疼痛,便利舒適的創新解決方案。
目標產品概況|APP13007
- 發展自台新藥專屬的APNT®奈米微粒製劑技術平台,在美已經成功完成三期臨床試驗及通過美國FDA審查,取得美國藥品上市許可
- 適應症為治療眼科手術術後的發炎及疼痛
- 適用美國FDA 505(b)2新藥上市路徑,首次將最強效的Class I皮質類固醇丙酸氯倍他索應用於眼科疾病治療上
- 突破性的點藥方案:一天2次,每次一滴,只要2週
- 具良好的安全性,臨床安全性與安慰劑組相當
- 滴點眼次數少及治療期間短;給藥模式簡單便利
- 具擴大應用於其他眼科炎症疾病的潛力
合作夥伴|APP13007

- 台新藥已完成以下區域的對外授權:
- 美國市場:Harrow, Inc.(NASDAQ:HROW)
- 中國大陸及港澳市場:遠大醫藥
- 中東及北非市場:Tabuk Pharmaceuticals Manufacturing Company
- 以色列市場:Tzamal Biopharma Ltd.
- 加拿大及墨西哥市場:Apotex Inc.
- 葡萄牙市場:DÁVI Farmacêutica
- 瑞士市場:Medvisis Switzerland AG
- 印度等南亞市場、部份東南亞市場、部份非洲、部份拉美市場:Cipla Limited
- 智利、秘魯等拉美市場:Laboratorios Saval S.A.
- 歐洲及巴西市場:Adalvo Limited
- 我們也歡迎上述以外其他區域的眼科專科藥廠與我們聯繫交流合作機會,了解更多。
獨特定位及創新|APP13007
APP13007的定位策略
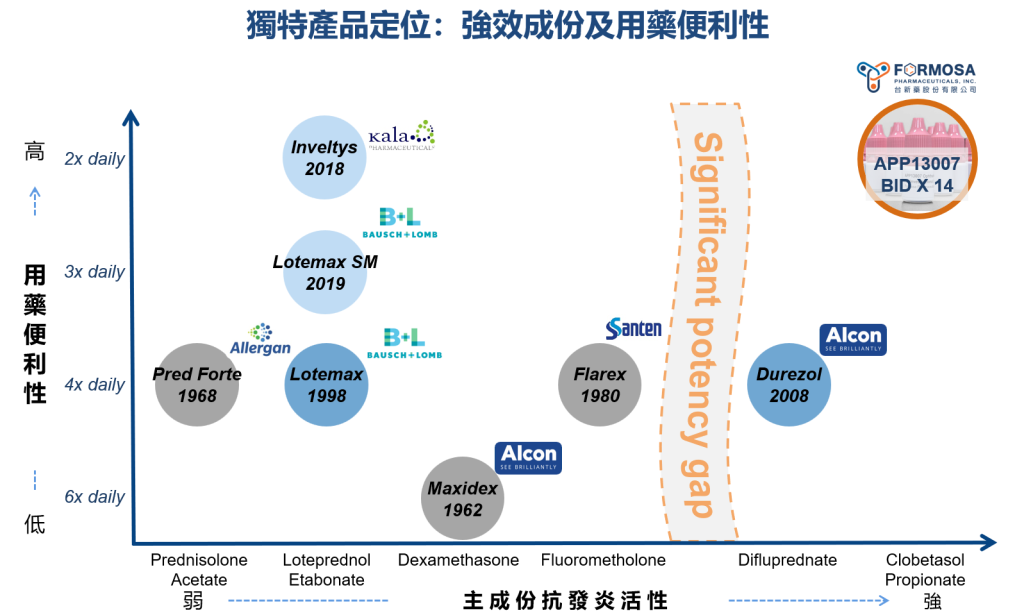
使用更強效的藥物、創新製劑技術來增進使用方便性及點眼用藥順從性。
- APP13007使用最強效Class1皮質類固醇的創新眼科藥物及台新藥專屬APNT™奈米微粒製劑技術平台。
- 相較於市售的類固醇眼藥水,APP13007提供眼科醫師及患者新的用藥選擇,用藥模式直接明確,更方便安全。
- 均質分佈的高品質納米懸浮液,確保每一滴藥液的品質與療效都一致。
- 根據APP13007的三期臨床試驗:
- 療效:顯示優於已上市同類藥物的潛力。
- 安全性:在APP13007三期試驗中顯示,與安慰劑的安全性數據相當;眼壓上升的情形不常見。。
- 舒適性:患者反應點眼時無異物感、感覺如水一般,不刺激。
第三期臨床試驗摘要|APP13007
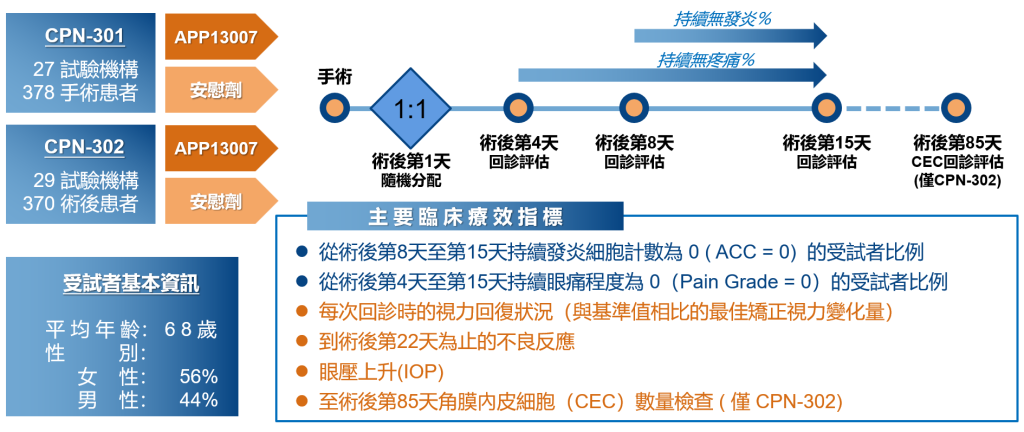
APP13007第3期臨床試驗設計摘要
CPN-301是一項在美國進行之隨機、雙盲、安慰劑對照的臨床試驗。378 名白內障手術術後受試者以1:1比例分配到APP13007用藥組或安慰劑組參與本試驗。每天給予兩次APP13007 點眼,每天一滴,共14天。試驗的主要療效指標為評估白內障手術後眼部發炎完全消失及疼痛完全緩解並持續的受試者比例。
CPN-302是一項在美國進行之隨機、雙盲、安慰劑對照的臨床試驗。370 名接受白內障手術的受試者以1:1比例分配到APP13007用藥組或安慰劑組參與本試驗。給藥方式同CPN-301。試驗的主要療效指標包括與CPN-301的指標之外,另包含角膜內皮細胞研究子實驗。
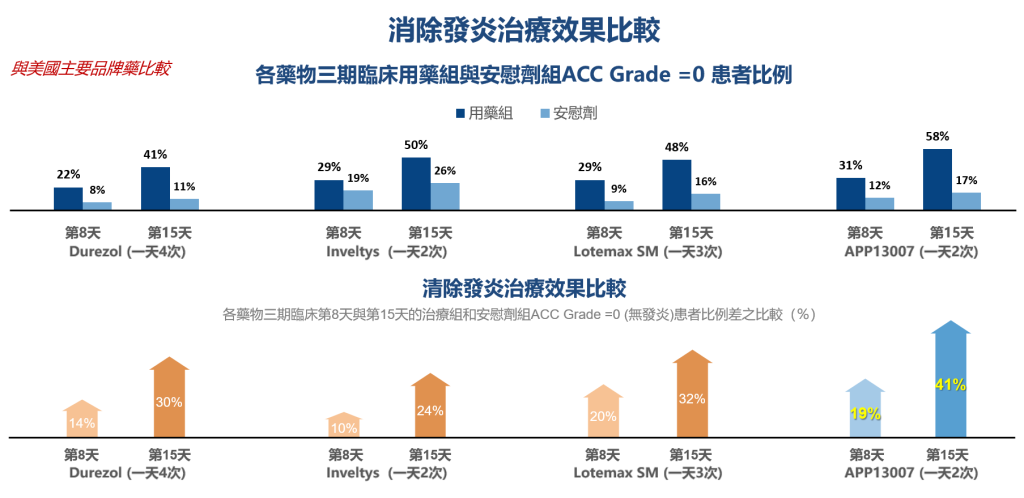
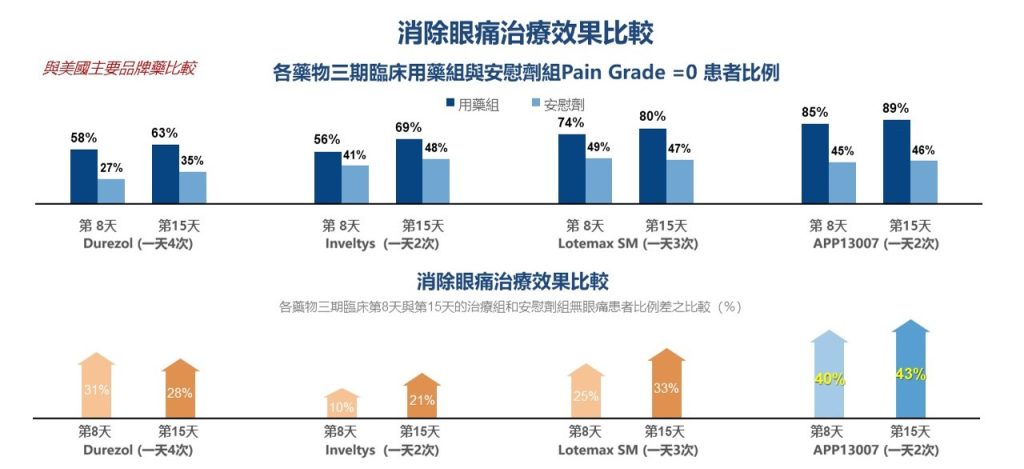
三期試驗結果與美國市售品比較:
相較於其他美國標準治療藥物,APP13007能更快速清除術後眼部發炎
相較於其他美國標準治療藥物,APP13007:快速且持續緩解眼部疼痛
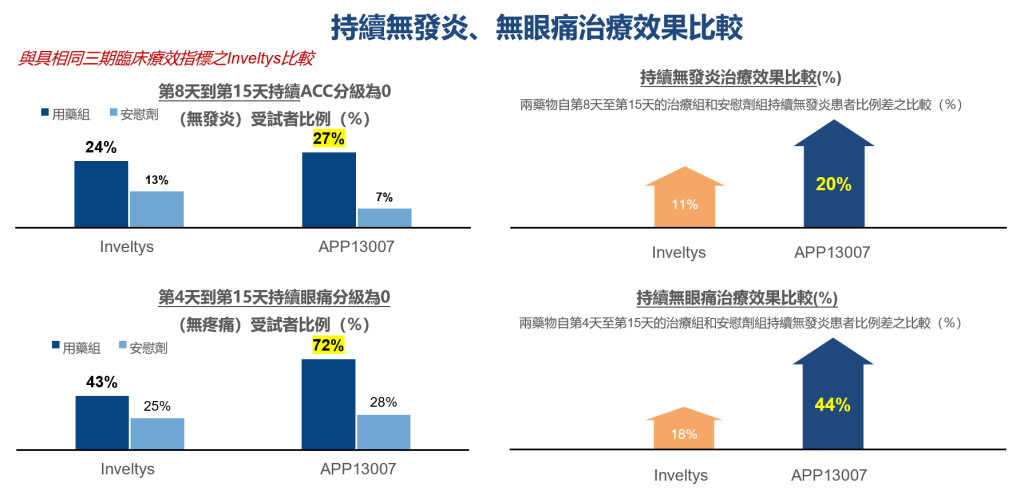
相較近年美國2018年上市藥物Inveltys,APP13007顯示突出的療效:持續消除白內障術後眼部發炎及疼痛。
APNT®奈米技術平台|帶給APP13007優勢與臨床利益
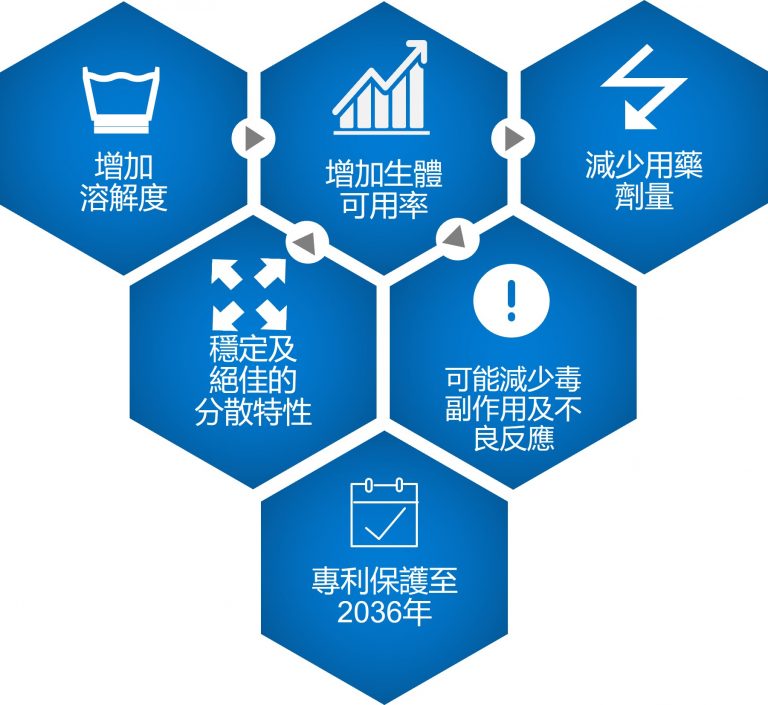
台新藥 APNT®奈米製劑技術及APP13007奈米懸液介紹
APP13007
(Clobetasol Propionate Ophthalmic Nanosuspension 0.05%)
Powered By APNT® Drug Delivery Technology
關於白內障手術及眼科手術

白內障是水晶體變得混濁的疾病。老化是主要發生的原因。
在80歲以上的族群中幾乎100%都可以發現白內障。
由於全球嬰兒潮世代的老化,白內障患者的數量快速上升。根據GlobalData的統計,目前在7大主要醫藥市場(美國、5大主要歐洲國家、日本)顯示約有將近7500萬名白內障患者,此外,在中國大陸也至少有5400萬名白內障患者。
白內障手術是用人工水晶體(intraocular lens)取代已經混濁的水晶體的手術。
由於近年人工水晶體的技術進步,全球眼科醫師的手術經驗快速增加。在許多如美國、日本、法國及德國等OECD國家當中,白內障手術率(Cataract Surgery Rate, CSR)已經超過10000,此亦即每百萬人當中曾接受白內障手術者超過10000人。
根據Market Scope和Evaluate Pharma的資料,在美國,2021年白內障手術的數量達到450萬次。在美國,白內障手術大約佔了眼科手術的60%;LASIK(層狀角膜內層重塑術)、近視手術、晚期青光眼、視網膜手術等佔剩餘的40%,全體眼科手術數量每年以穩定的速度成長。
在中國大陸,白內障手術的數量正在快速增加,2019年已經達到430萬次手術,估計以每年15%的速度增加。
白內障手術的術後併發症包括了晶體後囊破裂、眼內發炎、眼部術後感染以及眼壓上升等。
在這當中,最常發生的是手術後的強烈發炎反應,可能會造成視力受損、眼痛及不適等症狀。通常眼科醫師會處方類固醇眼藥水到治療計畫當中來抑制發炎以及疼痛。
現有類固醇眼藥水未能滿足的臨床需求
治療依從性:
- 根據研究指出,因點眼治療方案的複雜性,患者對眼藥水治療的順從性較低,約有30%的不依從率。
- 一項研究*指出接受白內障手術的病人在手術後第一天約有5%的患者無法順入將眼藥水滴入眼睛;有64%的患者沒有滴入正確滴量的眼藥水。
資料來源:Cataract Refract Surg. 2014;40(11):1857-1861
療效:
- 術後反覆的發炎和疼痛的發作影響治療結果及患者滿意度。
- 由於療效不足或是藥物起效慢導致眼科醫師常處方類固醇眼藥水超過30天。
安全性及眼壓上升:
- 現有標準療法以及學名藥的類固醇眼藥水可能有較高的可能性引發眼壓上升。(長期釋放的類固醇眼內植入物或注射劑造成眼壓上升的發生率甚至高達6~11%)。
舒適性與便利性:
- 因為藥物指標成份及配方的限制,現有標準療法的類固醇眼藥水
- 常引起眼睛感覺刺痛及異物感或視力模糊。
- 在點眼前患者需要用力搖晃眼藥水瓶使點眼懸液藥物均勻分散再點藥。
重新定義眼科術後體驗: 臨床證明,相較已上市的同類藥物,APP13007具潛力提供更好的療效 / 更好的安全性 / 更好的順從性 / 更好的舒適性。 請下載APP13007產品介紹以了解更多:








